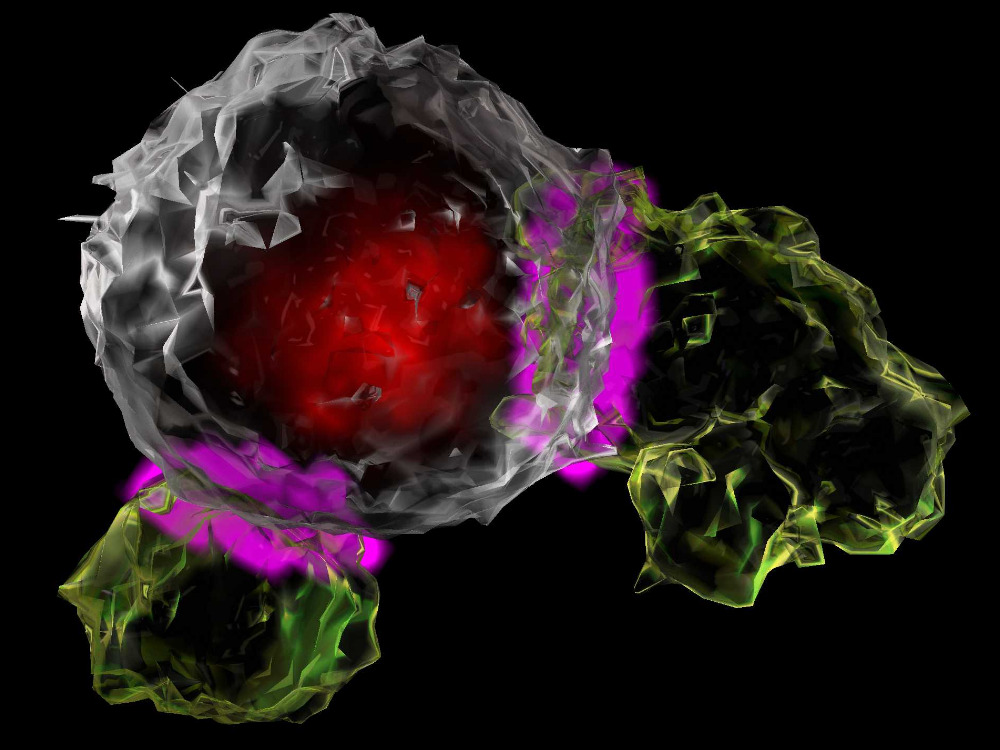
Gleich mehrere Durchbrüche wurden in diesem Jahr im Kampf gegen Krebserkrankungen gemeldet. Besonders im Fokus steht dabei die Immuntherapie, bei der Abwehrzellen im Körper so verändert werden, dass sie Krebszellen erkennen und bekämpfen können. Welche Therapien gibt es schon jetzt und gegen welche Arten von Krebs wirken sie? In unserem Podcast »Tonspur Wissen« hat die Journalistin Ursula Weidenfeld den Tumor-Immunologen und Internisten Philipp Beckhove vom Leibniz-Institut für Immuntherapie (RCI) gefragt.
LEIBNIZ Herr Beckhove, derzeit liest man immer öfter von Durchbrüchen im Kampf gegen Krebs, die auf der sogenannten Immuntherapie basieren. Was ist dran an den Erfolgsmeldungen?
PHILIPP BECKHOVE Ich denke, dass wir durchaus einige Durchbrüche erlebt haben und auch weiterhin erleben werden. Im Grunde genommen blicken wir jetzt auf fast zehn Jahre zurück, in denen sich gezeigt hat, dass Immuntherapien, also die Nutzung des Immunsystems gegen Krebs, funktionieren können. Bei manchen Krebserkrankungen werden sie sogar schon als Standardtherapien eingesetzt.
Von was für Durchbrüchen sprechen Sie genau?
Man konnte durch die Nutzung des Immunsystems und der Immunabwehrkräfte zum ersten Mal weit fortgeschrittene Tumoren zum Verschwinden bringen, die bisher überhaupt nicht behandelbar waren. Zum Beispiel metastasierende Krebsarten, bei denen keinerlei Therapien mehr wirksam waren. Unser Verständnis für die Art und Weise, wie das Immunsystem mit Tumoren interagiert und wie sich Tumore dagegen schützen können, hat sich wirklich grundlegend verändert.
Das Immunsystem ist durch diese Therapien also inzwischen in der Lage, degenerierte Zellen zu erkennen und anschließend mit weißen Blutkörperchen zu bekämpfen?
Es geht auf jeden Fall in diese Richtung. Der besagte Durchbruch bezieht sich auf solide Krebsformen. Damit sind zum Beispiel die klassischen metastasierenden Krebsformen wie Lungenkarzinome oder der schwarze Hautkrebs gemeint. Hier hat man festgestellt, dass das Immunsystem bei vielen Patienten durchaus aktiv wird gegen den Tumor und diesen häufig auch erkennen kann. Allerdings können die Tumorzellen, die ja selbst aus dem Körper hervorgegangen sind, die Immunzellen gewissermaßen abschalten. Diese Abschaltvorrichtung haben Grundlagen-Immunologen entdeckt und dafür vor einigen Jahren den Nobelpreis für Medizin erhalten. In der Folge konnten Medikamente entwickelt werden. Sie verhindern, dass die Abschaltvorrichtung wirksam wird.

Warum gibt es diese Abschaltvorrichtung überhaupt?
Im Grunde ist sie eine Art Bremse, die eine zu starke Reaktion durch das Immunsystem unterdrückt. Das ist wichtig, damit wir keine Autoimmunerkrankungen bekommen. Wenn also eine starke Immunantwort im Körper stattfindet, bei der auch normales, gesundes Gewebe mitgeschädigt werden könnte, wird die Abschalttaste aktiviert. Immunzellen hören dann auf, aggressiv gegen das Gewebe vorzugehen. Genau diese Taste aktiviert auch der Tumor. So kann er wachsen, obwohl das Immunsystem eigentlich gegen ihn vorgehen könnte.
Diesen Schalter müssten wir also wieder umlegen?
Wenn wir die Bremse mithilfe von Medikamenten blockieren, dann wird der Tumor bei einigen Krebsarten tatsächlich sehr effizient bekämpft. Das war der erste echte Durchbruch in der Tumorimmuntherapie. Heutzutage gibt es eine ganze Reihe von Tumoren, bei denen diese Therapien wirksam sind.
Das Prinzip hört sich gar nicht so kompliziert an. Warum ist es uns jetzt erst bekannt, und warum funktioniert es nicht bei allen Krebsarten?
Wir kennen diese Fähigkeit des Immunsystems noch gar nicht so lange. Außerdem muss man sie im Kontext des Tumors verstehen: Lange Zeit wurde ja vermutet, dass das Immunsystem den Tumor als Teil des eigenen Körpers nicht erkennen kann. Es waren deshalb zwei parallele Untersuchungsstränge notwendig: einerseits, um zu verstehen, dass das Immunsystem Tumore sehr wohl erkennen kann und andererseits, um festzustellen, wie der Tumor es ausbremst.
Ist das der Grund, weshalb auch jetzt noch relativ viele Studien zur Immuntherapie laufen und viele Patienten noch nicht mit ihr behandelt werden?
Ja. Die aktuellen Immuntherapien werden Immun-Checkpoint-Blockaden genannt. Der Immun-Checkpoint ist die beschriebene Bremse, die der Tumor benutzt und die wir mit dem Medikament blockieren. Das ist eine wichtige Variante der Immuntherapie, mit der wir aber nicht jeden Patienten wirksam behandeln können. Auch können wir nicht die Mehrheit der Patienten, bei denen man eine Wirksamkeit sieht, dauerhaft heilen. Wir müssen noch besser verstehen, warum die Therapie bei manchen Patienten gar nicht wirkt und es bei anderen eine gewisse Zeit braucht, bis sie anschlägt.
Was weiß man schon heute?
Wir verstehen schon etwas von den Bedingungen, unter denen solche Immun-Checkpoint-Therapien wirksam sein können. Zum Beispiel, wenn es bereits eine grundlegende Immunantwort gibt. Dann lohnt es sich, diese Bremse zu lösen, damit der Körper den Tumor abstoßen kann. Viele Tumore werden vom Immunsystem aber kaum erkannt oder haben so starke, zusätzliche Bremsen aktiviert, dass es nicht reicht, nur eine oder zwei davon zu lösen.
Hoffnungsfroh sind wir in vielen Fällen.
PHILIPP BECKHOVE
Wenn ein Patient keine Immunantwort auf einen Tumor zeigt, kann man seinen Krebs also nicht mit dieser Therapie behandeln?
Zumindest nicht mit den Immun-Checkpoint-Inhibitoren. Und hier setzen die aktuellen Studien an, die neue, zusätzliche Ansätze kombinieren und ausprobieren, wie die Immunantwort in die Wege geleitet werden kann. Weitere Fragen sind, welche zusätzlichen Mechanismen der Tumor nutzt, um das Immunsystem zu unterdrücken. Können wir sie ausschalten, um die Immunantwort aufzubauen und in Kombination mit den jetzt wirksamen Immun-Checkpoints eine Tumorabstoßung erreichen? Theorien gibt es dazu viele. Doch welche davon am Ende wirklich eine wirksame Therapie ermöglichen, kann man nur in klinischen Studien herausfinden.
Für welche Krebsarten gibt es bereits standardisierte Verfahren und die Hoffnung auf gute Therapien?
Hoffnungsfroh sind wir in vielen Fällen. Zugelassen sind solche Behandlungen bereits beim Lungenkrebs, beim schwarzen Hautkrebs, bei Blasen- und Nierenkrebs aber auch beim Kehlkopfkrebs und verwandten Tumoren im Kopf-Hals-Bereich. Zu vielen anderen Tumoren laufen noch Studien. Bei anderen Krebsarten, zum Beispiel beim Bauchspeicheldrüsenkrebs, Kolonkarzinom oder Hirntumoren, wissen wir dagegen schon, dass es besonders schwer ist. Hier gilt es noch herausfinden, warum die Immuntherapie bisher nicht wirklich wirksam ist. Allerdings haben wir noch eine andere Art von Tumoren, die man mit einer ganz anderen Immunzelltherapien sehr gut behandeln kann.
Welche Tumore sind das?
Die Lymphome, also Lymphdrüsenkrebs und einige Formen von Leukämie. Das sind flüssige Krebsformen, die auf das blutbildende und lymphatische System zurückgehen. Sie behandelt man eher nicht mit Immun-Checkpoint-Blockern, sondern geht wie bei einer Knochenmarktransplantation mit Immunzellen in die Therapie, insbesondere mit T-Lymphozyten. Die haben sozusagen eine Killerkapazität und sind in der Lage, andere Zellen sehr effizient zu zerstören.
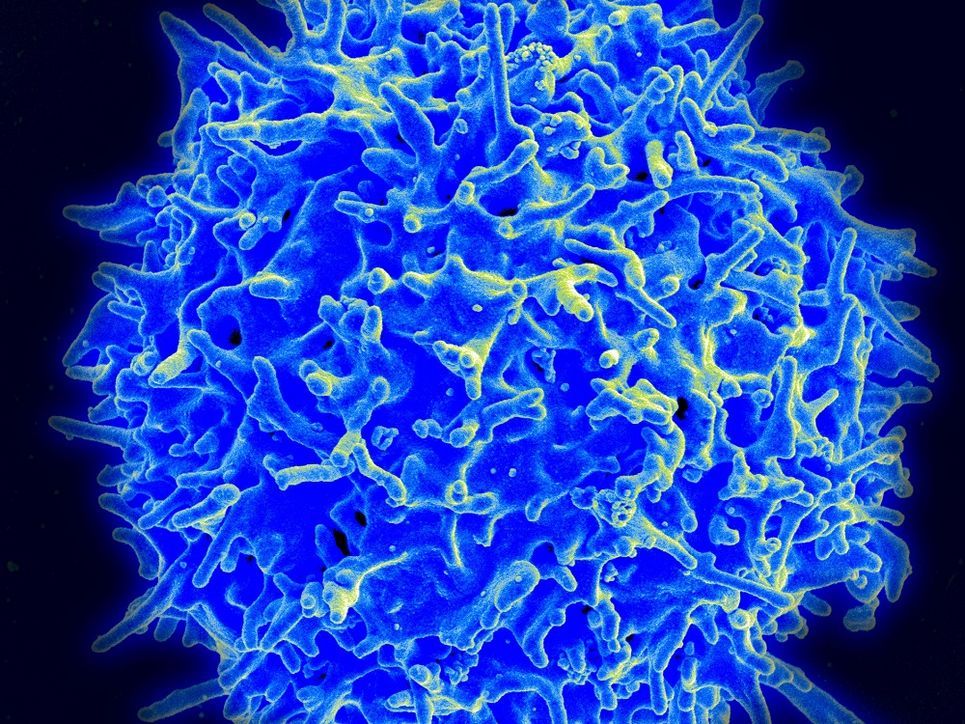
Und mit dieser »Killerfunktion« können T-Zellen also degenerierte Zellen bekämpfen und töten?
Normalerweise sind sie dazu da, von Viren befallene Zellen zu erkennen und gemeinsam mit dem Virus zu zerstören. Mit ihrer Hilfe kann man Viruserkrankungen deshalb sehr schnell und effizient behandeln. Wenn eine Tumorzelle als fremd erkannt wird, können sie aber auch diese Zellen attackieren. Gerade bei der Behandlung flüssiger Tumore haben sich die T-Lymphozyten als effizient erwiesen. Mit ihnen kann man Lymphome oder auch bestimmte lymphatische Leukämien behandeln, indem man sie mit einem Erkennungsrezeptor ausstattet.
Wie funktioniert das?
Mit Gentherapie. Wir müssen eine solche T-Zelle nehmen und ihr eine Erkennungsstruktur für bestimmte Eigenschaften der Tumorzellen einsetzen, was über die Eingabe von Erbinformationen erfolgt. Damit kann die T-Zelle auch entartete, bösartige Krebszellen sehr effizient erkennen. Zugelassen ist die sogenannte CAR-T-Zell-Therapie bisher aber nur für die Behandlung von fortgeschrittenem und schwer behandelbarem Lymphdrüsenkrebs und bei bestimmten lymphatischen Leukämien von Kindern und Jugendlichen.
Ist das ein ähnliches Prinzip, wie es bei den mRNA-Impfstoffen gegen Covid angewandt wird?
Von der Idee her ist die Gentherapie ein ähnlicher Ansatz. Aber diese Methode unterscheidet sich doch in sehr zentralen Parametern von der Covid-Impfung. Denn hier werden Corona-Merkmale für eine kurze Zeit vom Körper des Patienten selber hergestellt und lösen eine Antivirusantwort im Körper aus. Das ist im Prinzip wie eine Impfung, aber auf der Basis einer kurzfristigen, genetischen Veränderung.
Und bei der Immuntherapie ist es anders?
Da werden diese Geninformation dauerhaft in den Zellkern eingebaut. Eine T-Zelle wird also für immer in der Lage sein, eine Tumorzelle zu erkennen und die Wiederkehr der Tumorzellen zu verhindern. Zumindest, solange sie beim Patienten vorhanden sind.
Gibt es dafür schon gute Beispiele?
Ja, die ersten Patienten, die vor zehn Jahren mit diesem Prinzip behandelt wurden, leben heute noch und sind frei von Tumoren. Zum Teil kann man die genveränderten T-Zellen sogar immer noch nachweisen.
Hinter der CAR-T-Zelltherapie steht also die Idee, im Idealfall für den Rest des Lebens Ruhe zu haben?
Natürlich wird auch durch diese Therapien nicht jeder geheilt. Auch wenn die CAR-T-Zellen in der Regel immer die Fähigkeit haben, ihr Tumormerkmal zu entdecken, kann es passieren, dass die Tumorzellen sich verändern. Wenn Tumorzellen dieses Merkmal durch Veränderung oder Mutation plötzlich nicht mehr haben, können die CAR-T-Zellen sie auch nicht mehr erkennen. So kann es dazu kommen dass der Tumor wiederkehrt. Aber in deutlich mehr Fällen wirkt die Therapie effizient und führt zu einem dauerhaften Verschwinden des Tumors.
Warum behandelt man damit nicht alle Krebsarten?
Weil es bisher bei vielen Tumoren noch nicht funktioniert. Tumorzellen entstehen aus gesunden Zellen und teilen deshalb viele Oberflächeneigenschaften mit ihnen. Es besteht die Gefahr, das fälschlicherweise gesundes Gewebe ins Visier gerät. Außerdem ist es für T-Zellen manchmal schwierig, in solide Tumore einzudringen, anders als bei Lymphomen oder flüssigen Tumoren. Sie müssen ja irgendwie einen Weg hineinfinden und dann gegen ein Milieu ankämpfen, in welchem viele immunsuppressive Mechanismen aktiv sind. Auch in unserem Institut schauen wir uns an, welche zusätzlichen Funktionen eine solche CAR-T-Zelle bräuchte, damit sie in diesem Milieu überleben kann, funktionstüchtig bleibt und dabei sehr immun-resistente Tumorzellen knacken und zerstören kann.
Wissen Sie auch, warum Immuntherapien etwa bei einem Drittel der Patienten gar nicht wirken?
Tumor ist nicht gleich Tumor. Je nachdem, wo er sich bildet und welche Störungen der Zellen vorhanden sind, haben wir es mit völlig unterschiedlichen Erkrankungen zu tun. Mit der Identifizierung dieser Bremse wurde ein sehr zentrales Prinzip aufgedeckt, das die Immunresistenz eines gewissen Teils von Tumoren erklären kann. Bei einigen anderen Arten laufen diese Experimente und Erkenntniswege im Moment noch. Ich bin sicher, dass wir nach und nach auch für weitere Tumore verstehen, wie man sie besser behandeln kann. Aber das geht eben nur schrittweise.
TONSPUR WISSEN
Das Gespräch mit Philipp Beckhove vom Leibniz-Institut für Immuntherapie(RCI) können Sie in voller Länge im Podcast Tonspur Wissen
von Rheinischer Post und der Leibniz-Gemeinschaft hören. Für leibniz
haben wir es leicht gekürzt und bearbeitet. Im Podcast widmet sich die Journalistin Ursula Weidenfeld aktuellen Themen und Entwicklungen und spricht darüber mit Wissenschaftlerinnen und Wissenschaftlern aus der Leibniz-Gemeinschaft. Alle Folgen des Podcasts finden Sie hier.